- Autors Alex Aldridge [email protected].
- Public 2023-12-17 13:45.
- Pēdējoreiz modificēts 2025-01-23 11:14.
Galvenā atšķirība starp hidrazīnu un karbohidrazīdu ir tāda, ka hidrazīns satur H2N-NH2 struktūru, turpretim karbohidrazīds satur divas hidrazīna molekulas, kas pievienotas vienam karboniloglekļa centram.
Hidrazīns un karbohidrazīds ir ķīmiski savienojumi, kas satur H2N-NH2 vienības. Vienu šīs ķīmiskās struktūras vienību sauc par hidrazīnu, savukārt ogļhidrazīdam ir divas no šīm struktūrām, kas pievienotas karboniloglekļa centram.
Kas ir hidrazīns?
Hidrazīns ir neorganisks savienojums ar ķīmisko formulu N2H4. Mēs to varam nosaukt par vienkāršu pnitogēna hidrīdu, un tas ir bezkrāsains un viegli uzliesmojošs šķidrums ar amonjaka smaku. Šis savienojums ir ļoti toksisks, un mums ar šo vielu jārīkojas uzmanīgi. Tā toksicitāte samazinās, ja to lieto šķīdumā, piem. hidrazīna hidrāts.

Attēls 01: Hidrazīna hidrāts
Hidrazīns galvenokārt ir noderīgs kā putotājs, kas ir svarīgs polimēru putu gatavošanā. Turklāt tas ir noderīgs kā polimerizācijas katalizatoru, farmaceitisko līdzekļu un agroķīmisko vielu prekursors, kā arī ilgstoši uzglabājams propelants kosmosa kuģu piedziņai.
Ir daudzi dažādi ceļi hidrazīna ražošanai, tostarp amonjaka oksidēšana, izmantojot oksaziridīnus no peroksīda, hloru saturošas oksidācijas utt. Apsverot hidrazīna reakcijas, tas parāda skābju-bāzes uzvedību, kad hidrazīns var veidot monohidrāts, kas ir blīvāks nekā bezūdens forma, un tam ir bāzes (sārmu) īpašības, kas ir salīdzināmas ar amonjaku. Turklāt hidrazīns var tikt pakļauts redoksreakcijas, jo tas var darboties kā reducētājs, radot blakusproduktus, kas parasti ir slāpeklis un ūdens.
Kas ir ogļhidrazīds?
Ogļhidrazīds ir organisks savienojums ar ķīmisko formulu H4N2-C(=O)-N2H4. Šī viela parādās kā b alta, ūdenī šķīstoša cieta viela, kas kušanas laikā sadalās. Ir vairāki karbazīdi, kuros viena vai vairākas N-H grupas ir aizstātas ar citiem aizvietotājiem.
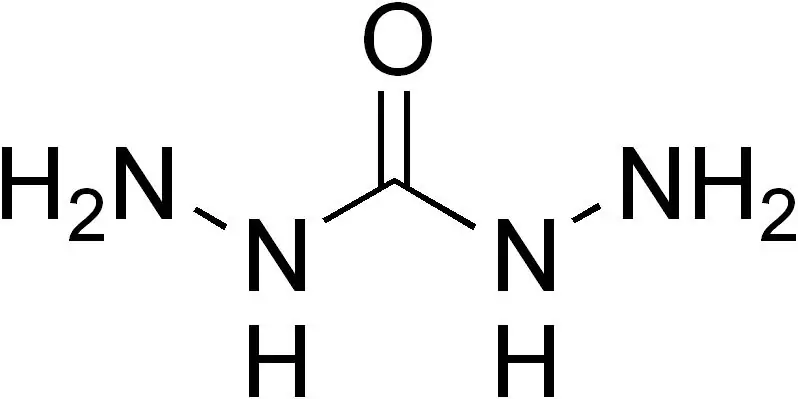
Attēls 02: Ogļhidrazīda molekulas struktūra
Mēs varam ražot šo vielu rūpnieciski, apstrādājot urīnvielu ar hidrazīnu. Mēs varam arī sagatavot šo vielu, reaģējot citiem C1 prekursoriem ar hidrazīnu, tostarp karbonātu esteriem.
Ogļhidrazīda molekula ir nepolāra molekula, un visi slāpekļa centri šajā molekulā ir vismaz nedaudz piramīdas formas, kas norāda uz vājāku C-N pi saiti.
Apsverot šī savienojuma lietojumus, tas ir noderīgs kā skābekļa attīrītājs, polimēru prekursors, noder fotogrāfijā kā stabilizators, svarīgs munīcijas propelentu izstrādē, stabilizējot ziepes utt.
Kāda ir atšķirība starp hidrazīnu un ogļhidrazīdu?
Hidrazīns un karbohidrazīds ir slāpekli saturoši ķīmiski savienojumi. Galvenā atšķirība starp hidrazīnu un ogļhidrazīdu ir tāda, ka hidrazīns satur H2N-NH2 struktūru, turpretim karbohidrazīds satur divas hidrazīna molekulas, kas pievienotas vienam karboniloglekļa centram. Turklāt mēs varam klasificēt hidrazīnu kā neorganisku savienojumu un ogļhidrazīdu kā organisku savienojumu, jo hidrazīna molekulās nav oglekļa atomu, lai gan karbohidrazīds satur karboniloglekļa centru.
Turklāt mēs varam ražot hidrazīnu, izmantojot amonjaka oksidēšanu, izmantojot oksaziridīnus no peroksīda, hlora bāzes oksidācijas utt., un karbohidrazīdu, apstrādājot urīnvielu ar hidrazīnu.
Zemāk infografikā tabulas veidā ir parādīta sīkāka informācija par atšķirību starp hidrazīnu un karbohidrazīdu.

Kopsavilkums - hidrazīns pret ogļhidrazīdu
Hidrazīns un karbohidrazīds ir slāpekli saturoši ķīmiski savienojumi. Galvenā atšķirība starp hidrazīnu un ogļhidrazīdu ir tāda, ka hidrazīns satur H2N-NH2 struktūru, turpretim karbohidrazīds satur divas hidrazīna molekulas, kas pievienotas vienam karboniloglekļa centram. Turklāt hidrazīns parādās kā bezkrāsains šķidrums, savukārt ogļhidrazīds ir b alta cieta viela.






