- Autors Alex Aldridge [email protected].
- Public 2023-12-17 13:45.
- Pēdējoreiz modificēts 2025-06-01 07:37.
Galvenā atšķirība starp ogļskābi un bikarbonātu ir tā, ka ogļskābe ir neitrāls ķīmisks savienojums, savukārt bikarbonāts ir negatīvi lādēts ķīmisks savienojums.
Ogļskābe ir vāja skābe, kas veidojas šķīdumā, kad oglekļa dioksīds izšķīst ūdenī, ar ķīmisko formulu H2CO3. Bikarbonāts veidojas, apvienojot trīs skābekļa atomus, ūdeņraža atomu un oglekļa atomu ar ķīmisko formulu HCO3-.
Kas ir ogļskābe?
Ogļskābe ir H2CO3. Dažreiz mēs piešķiram šo nosaukumu šķīdumiem, kuros oglekļa dioksīds ir izšķīdināts ūdenī vai gāzētā ūdenī. Tas ir tāpēc, ka gāzēts ūdens satur nelielu daudzumu H2CO3. Turklāt ogļskābe ir vāja skābe, un tā var veidot divu veidu sāļus kā karbonātus un bikarbonātus. Šī savienojuma molārā masa ir 62,024 g/mol.
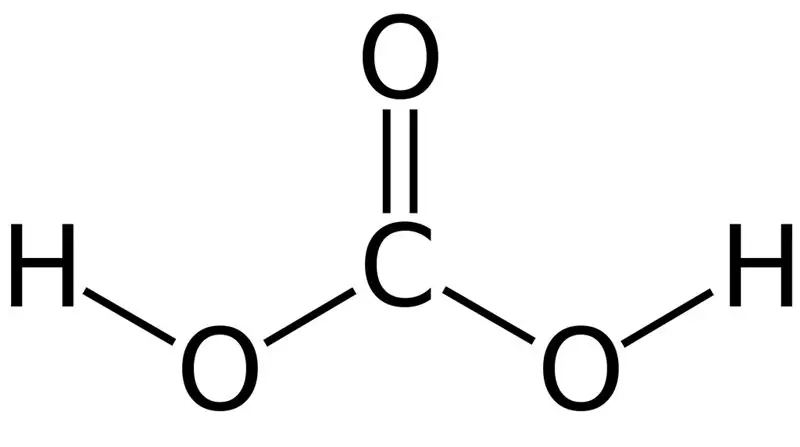
Attēls 01: Ogļskābes ķīmiskā struktūra
Kad oglekļa dioksīds izšķīst ūdenī, tas nonāk līdzsvarā starp oglekļa dioksīdu un ogļskābi. Līdzsvars ir šāds:
CO2 + H2O ⟷ H2CO3
Ja bāzei pievienojam pārāk daudz ogļskābes, tas dod bikarbonātu. Bet, ja ir pārāk daudz bāzes, tad ogļskābe mēdz dot gāzētos sāļus. Precīzāk, ogļskābe ir karbonskābes savienojums, kam ir divi hidroksilgrupas aizvietotāji, kas saistīti ar karbonilgrupu. Turklāt tā ir poliprotiska skābe, kas spēj ziedot protonus. Tam ir divi noņemami protoni, tāpēc tas ir īpaši diprotisks.
Kas ir bikarbonāts?
Bikarbonāts veidojas, apvienojot trīs skābekļa atomus, ūdeņraža atomu un oglekļa atomu. Šīs kombinācijas produkts var būt jons vai savienojums, kurā ir vairāk elektronu nekā protonu. Mēs to varam raksturot kā ķīmisku sugu ar ķīmisko formulu HCO3-.
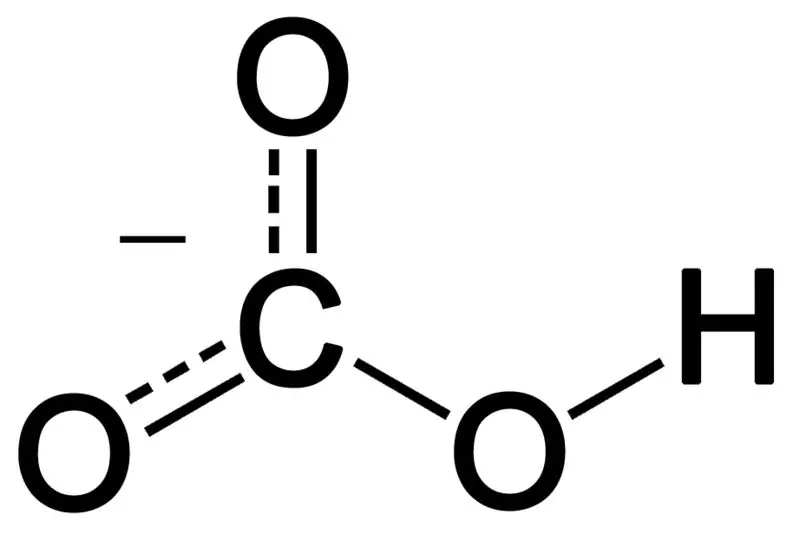
Attēls 02: Bikarbonāta anjona ķīmiskā struktūra
Šis savienojums ir svarīga ķermeņa pH bufersistēmas sastāvdaļa, runājot nespeciālistiskā izteiksmē: tas ir atbildīgs par to, lai asinis būtu ne pārāk skābā, ne pārāk bāziskā stāvoklī. Turklāt tas kalpo kā veids, kā kontrolēt gremošanas sulas, kad kuņģis ir pabeidzis pārtikas sagremošanu. Turklāt ogļskābe lietus ūdenī veido bikarbonāta jonus, kad tā skar akmeņus. Šī bikarbonāta jonu plūsma ir svarīga oglekļa cikla uzturēšanai.
Kāda ir atšķirība starp ogļskābi un bikarbonātu?
Ogļskābe ir vāja skābe, kas veidojas šķīdumā, kad oglekļa dioksīds izšķīst ūdenī, un tās ķīmiskā formula ir H2CO3. Bikarbonāts veidojas, apvienojot trīs skābekļa atomus, ūdeņraža atomu un oglekļa atomu ar ķīmisko formulu HCO3-. Galvenā atšķirība starp ogļskābi un bikarbonātu ir tā, ka ogļskābe ir neitrāls ķīmiskais savienojums, savukārt bikarbonāts ir negatīvi lādēts ķīmiskais savienojums. Turklāt ogļskābi izmanto burbuļojošu, gāzētu dzērienu gatavošanā, dermatītu ārstēšanā, mutes skalošanas līdzekļos u.c., savukārt bikarbonātu izmanto pārtikas produktos, piemēram, cepšanai (kā rauga līdzekli), un tas dod spēju pretoties pH izmaiņām.
Šajā infografikā tabulas veidā ir apkopotas atšķirības starp ogļskābi un bikarbonātu, lai veiktu salīdzinājumu.
Kopsavilkums - ogļskābe pret bikarbonātu
Ogļskābe ir H2CO3. Bikarbonāts veidojas, apvienojot trīs skābekļa atomus, ūdeņraža atomu un oglekļa atomu, ar ķīmisko formulu HCO3-. Galvenā atšķirība starp ogļskābi un bikarbonātu ir tā, ka ogļskābe ir neitrāls ķīmisks savienojums, savukārt bikarbonāts ir negatīvi lādēts ķīmisks savienojums.






